Introduction / introduzione
A issue of Science journal of july 2005 reported 100 questions that span the sciences (Sciences, 2005, vol. 309 – page 86). It is expected that some will drive scientific inquire for a long time while others may soon be answered.
A very intriguing question was: “What is the origin of homochirality in Nature?” The origin of the preference between mirror-images of natural molecules (such as amino acids and sugars) still remains a mistery.
Amino acids are important molecules in Nature by serving as metabolic intermediates or as building units for proteins synthesis. About 500 amino acids are known and have been classified in many ways (Wagner and Musso, 1983). The classification is based on:
– the position of the functional groups (α, β, γ, etc. depending on the position of the amino group against the carboxylic acid)
– the type of side chain group
– isomerism
– be proteinogenic or less
– be of natural origin or not.
All α-amino acids but glycine exist in either of the two enantiomers, which are mirror images of each other (the so called D- and L-enantiomers):
La prestigiosa rivista Science nel volume pubblicato a luglio 2005 riportò l’elenco delle 100 principali domande nella scienza (Sciences, 2005, vol. 309 – page 86). Gli autori proposero che alcuni di queste quesiti scientifici avrebbero richiesto molto tempo per essere risolti mentre altri sarebbero stati chiariti negli anni a seguire.
Una domanda molto interessante è stata: “Qual è l’origine della omochiralità in Natura?” L’origine della preferenza tra immagini speculari di molecole naturali (come si osserva per gli zuccheri e gli amino acidi) resta tuttora un mistero.
Gli amino acidi sono molecole fondamentali in Natura essendo utilizzati come intermedi metabolici o come le unità componenti le proteine. Sono conosciuti circa 500 amino acidi, i quali vengono classificati in molti modi diversi (Wagner e Musso, 1983) in base a:
– la posizione dei gruppi funzionali (α, β, γ, etc. in funzione della posizione del gruppo amminico rispetto a quello carbossilico)
– la natura chimica della catena laterale
– l’isomeria
– essere presente o meno nelle proteine
– essere o meno di origine naturale.
Tutti gli α-amino acidi, con la sola eccezione della glicina, esistono come due enantiomeri, ovvero come due immagini speculari (i cosiddetti enantiomeri D- e L-):
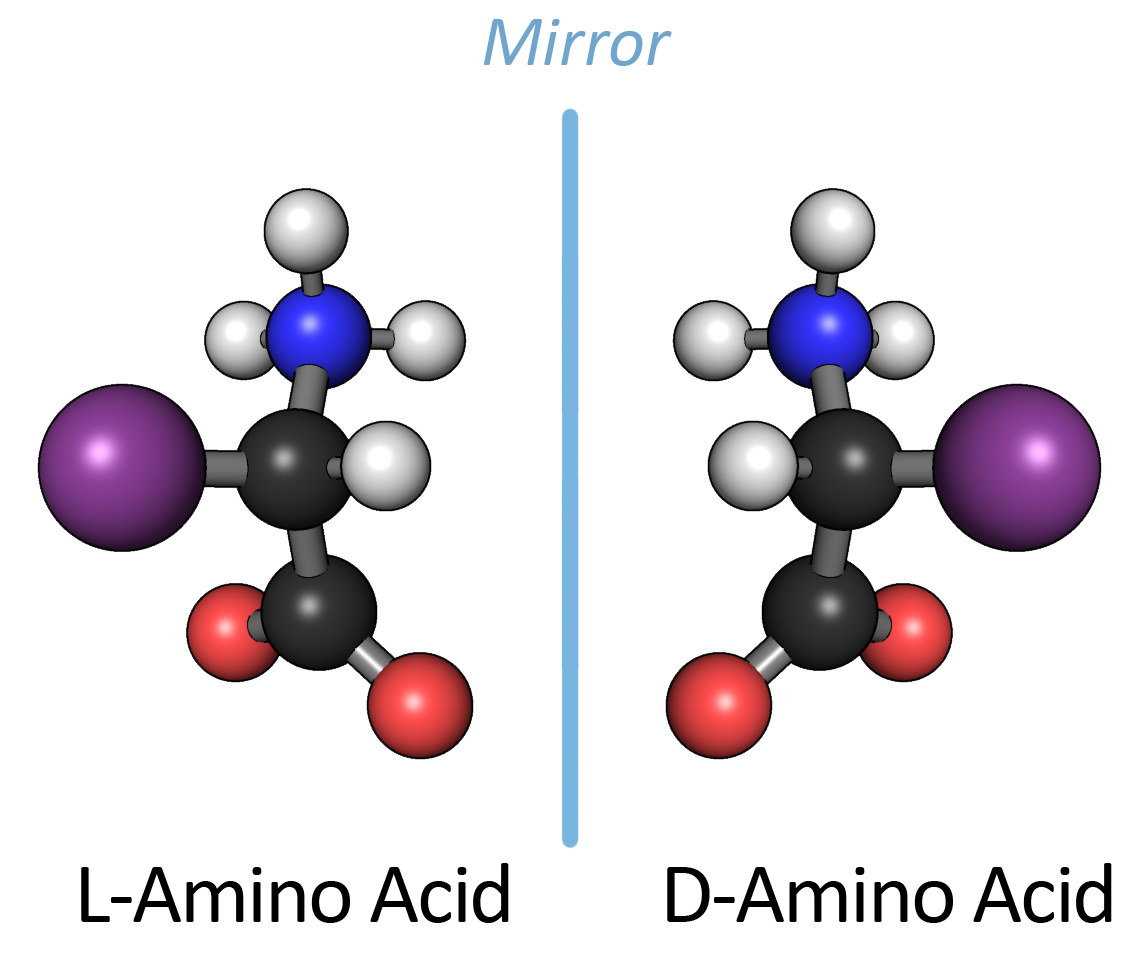
What are D-amino acids?
Amino acids exist in two orientations in the space: levorotatory (L-) and dextrorotatory (D-), also indicated as left-handed and right-handed. The majority of amino acids in living organisms are L-isomers (L-AA). In the past, D-amino acids (D-AA) have been considered unnatural amino acids that only exist in microorganisms and plants: the free D-isomers found in higher animals were assumed to be essentially by-products of dietary consumption. In the last few decades, taking advantage of the development of more sensitive analytical techniques, biochemists recently demonstrated the presence of D-AA in several molecules as well as in mammalian tissues and fluids. D-AAs play important roles in a number of physiological functions (from neurotransmission to biofilm formation, from endocrinology to pathogen resistance) and are also related to main human pathologies. This finding opened the questions related to their origin, synthesis, and different physiological roles.
Can tRNA select the L-enantiomer?
As a general rule, D-AAs do not bind tRNA molecules, thus their presence in proteins is related to posttranslational modifications (Doolitle, 1983).
Anyway, recently it was demonstrated that the cellular translational machinery accepts D-AA-tRNAs into the ribosomial aminoacyl-tRNA binding site A, uses it as a peptidyl-transfer acceptor, and traslocates the resulting peptidyl-D-AA-tRNA into the ribosomial P (peptidyl) site. Subsequently, the latter traps the ribosomal peptidyl – transferase center in a conformation that impairs peptidyl transfer (Englander et al., 2015)
References
Doolittle, R. (1983) Probability and the origin of life. In: Godfrey, L.R., ed., 1983. Scientists Confront Creationism, W.W. Norton, NY
Englander M.T. (2015) The ribosome can discriminate the chirality of amino acids within its peptidyl-transferase center. PNAS USA 19 (112): 6038-6043
Wagner I, Musso H. “New naturally occurring amino acids” (1983). Angewandte Chemie International Edition (22): 816-28
Authors:
Loredano Pollegioni
Cosa sono i D-amino acidi?
Gli amino acidi esistono in due orientamenti nello spazio: levogiro (L-) o destrogiro (D-), anche indicati come sinistrorso o destrorso. La maggioranza degli amino acidi negli organismi viventi sono degli L-isomeri (L-AA). In passato, i D-amino acidi (D-AA) erano considerati come amino acidi non-naturali, esistenti solo nei microorganismi e nelle piante: i D-AA liberi che venivano trovati negli animali superiori furono considerati come sotto-prodotti dell’alimentazione. Negli ultimi venti anni, lo sviluppo di tecniche analitiche più sensibili e sofisticate, hanno permesso ai biochimici di dimostrare la presenza dei D-AA in diverse molecole, così come in tessuti e fluidi dei mammiferi. I D-AA svolgono ruoli di primaria rilevanza in numerose funzioni fisiologiche (dalla neurotrasmissione alla formazione dei biofilm, dalla endocrinologia alla resistenza ai patogeni) e sono anche collegati a importanti patologie umane. Queste scoperte hanno condotto i ricercatori a porsi ulteriori quesiti riguardo ai D-AA tra cui la loro origine, le vie di sintesi e i diversi ruoli fisiologici.
Possono i tRNA discriminare tra L-AA e D-AA?
Come regola generale, i D-AA non si legano alle molecole dei tRNA (gli RNA transfer) e non possono entrare nella sintesi proteica, pertanto la loro presenza nelle proteine dipende da modifiche post-traduzionali (Doolittle, 1983).
Ciononostante, recentemente è stato dimostrato che il macchinario cellulare per la sintesi proteica accetta il complesso D-AA–tRNA nel sito A del ribosoma (quello per il legame del nuovo amino acido), lo usa come accettore nella formazione del legame peptidico, e poi trasferisce il complesso peptidil-D-AA-tRNA nel sito P (quello peptidilico). Successivamente, quest’ultimo blocca il centro peptidil-transferasico in una conformazione che altera ed impedisce il trasferimento del peptide formato (Englander et al., 2015).
Riferimenti bibliografici
Doolittle, R. (1983) Probability and the origin of life. In: Godfrey, L.R., ed., 1983. Scientists Confront Creationism, W.W. Norton, NY
Englander M.T. (2015) The ribosome can discriminate the chirality of amino acids within its peptidyl-transferase center. PNAS USA 19 (112): 6038-6043
Wagner I, Musso H. “New naturally occurring amino acids” (1983). Angewandte Chemie International Edition (22): 816-28
Autori:
Loredano Pollegioni
